IF=6.2!中科院茶叶研究所林智团队突破性成果:非靶向特定修饰代谢组学首次系统解析植物糖基化代谢物

英文标题:Nontargeted Modification-Specific Metabolomics Investigation of Glycosylated Secondary Metabolites in Tea (Camellia sinensis L.) Based on Liquid Chromatography-High-Resolution Mass
中文标题:基于液相色谱-高分辨质谱的茶糖基化次级代谢产物非靶向特定修饰代谢组学研究
发表期刊:Journal of agricultural and food chemistry
影响因子:6.2
研究背景
内源性修饰(如糖基化和酰化)广泛存在于生物体中,调控多种生物过程,并在植物小分子代谢物中尤为常见。这些修饰通过改变代谢物的极性、稳定性、生物活性等,帮助植物抵御生物和非生物胁迫,同时生成复杂的次级代谢物(如抗氧化剂、辅酶及辐射防护分子)。糖基化代谢物在植物中具有高度物种特异性,是药物、营养和风味成分的重要来源,但其大规模研究受限于分析技术。
近年来,代谢组学与高分辨质谱技术的进步推动了修饰代谢物的系统解析。通过引入非靶向特定修饰代谢组学(结合源内碰撞诱导解离技术),研究者已实现对尿液中900余个修饰代谢物(如乙酰化、糖基化等)的高通量检测,并发现大量未收录于数据库的新化合物。
茶 (Camellia sinensis)作为全球第二大饮品,其健康效应与风味特征主要源于丰富的次级代谢物(如黄酮类、类黄酮糖苷等)。然而,茶中仍有大量糖基化代谢物未被发现。本研究首次应用上述方法,系统解析茶中葡萄糖基化、半乳糖基化、鼠李糖基化、芸香糖基化及藤黄糖基化等修饰的次级代谢物,为茶的代谢组复杂性及功能成分挖掘提供新视角。
研究结果
代谢物糖基化鉴定策略
如图1所示,内源性代谢物糖基化会为代谢物底物增加特定分子量。在源内碰撞诱导解离(ISCID)过程中,通过中性丢失路径可去除所添加的配体,从而产生特定的中性丢失模式。在茶中糖基化代谢物的初步分析中,以槲皮素3-葡萄糖苷、山柰酚3-半乳糖苷、杨梅素3-鼠李糖苷、槲皮素3-芸香糖苷和水杨酸甲酯藤黄糖苷为标准品,分别研究了葡萄糖基化、半乳糖基化、鼠李糖基化、芸香糖基化和藤黄糖基化代谢物的特异性中性丢失(糖基化代谢物结构见图2)。
如图3所示,葡萄糖基化/半乳糖基化、鼠李糖基化、芸香糖基化和藤黄糖基化修饰的代谢物分别表现出理论特征中性丢失(NL)值为162.0528(C₆H₁₀O₅)、146.0579(C₆H₁₀O₄)、308.1107(C₁₂H₂₀O₉)和294.0951(C₁₁H₁₈O₉),这些特征可作为识别特定糖基化的指标(表1)。值得注意的是,葡萄糖基化和半乳糖基化的NL值均为162.0528,仅通过NL值无法区分两者。因此,需引入色谱保留行为:在C₁₈色谱柱上,半乳糖基化结合物的洗脱时间早于葡萄糖基化结合物。借助高分辨Q-TOF/MS仪器的优势,可轻松区分葡萄糖基化/半乳糖基化(NL=162.0528)与咖啡酰化(NL=162.0317),以及鼠李糖基化(NL=146.0579)与香豆酰化(NL=146.0368),而传统三重四极杆或Q-trap仪器的中性丢失扫描无法实现此区分。需注意的是,若化合物的糖基部分进一步发生酰化(如没食子酰化、香豆酰化或咖啡酰化),则通过ISCID无法产生对应的糖基化特征NL,因此无法通过非靶向特定修饰代谢组学方法检测到此类化合物。
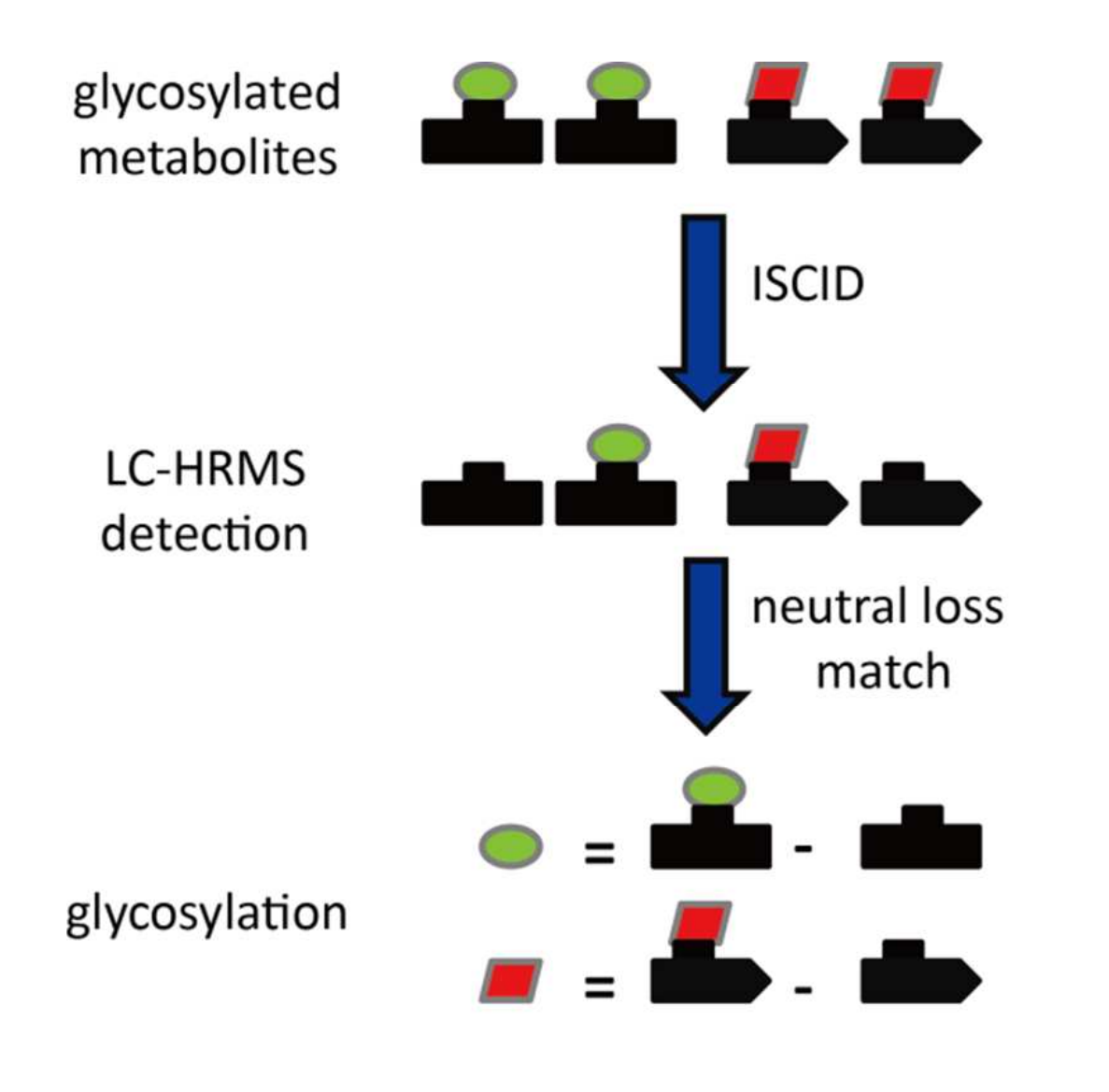
图1 茶中代谢物糖基化映射策略
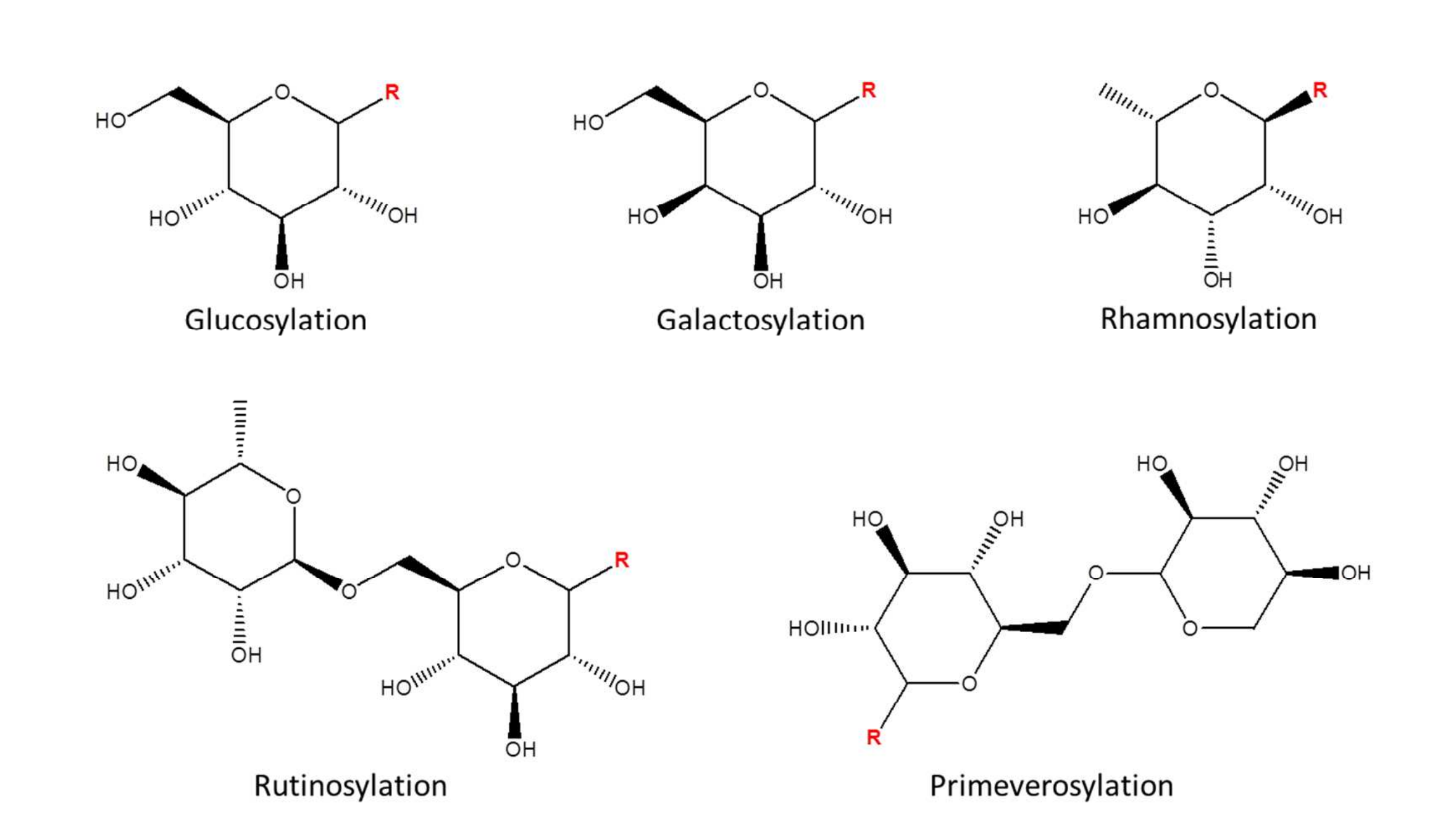
图2 本研究涵盖的代谢物糖基化结构
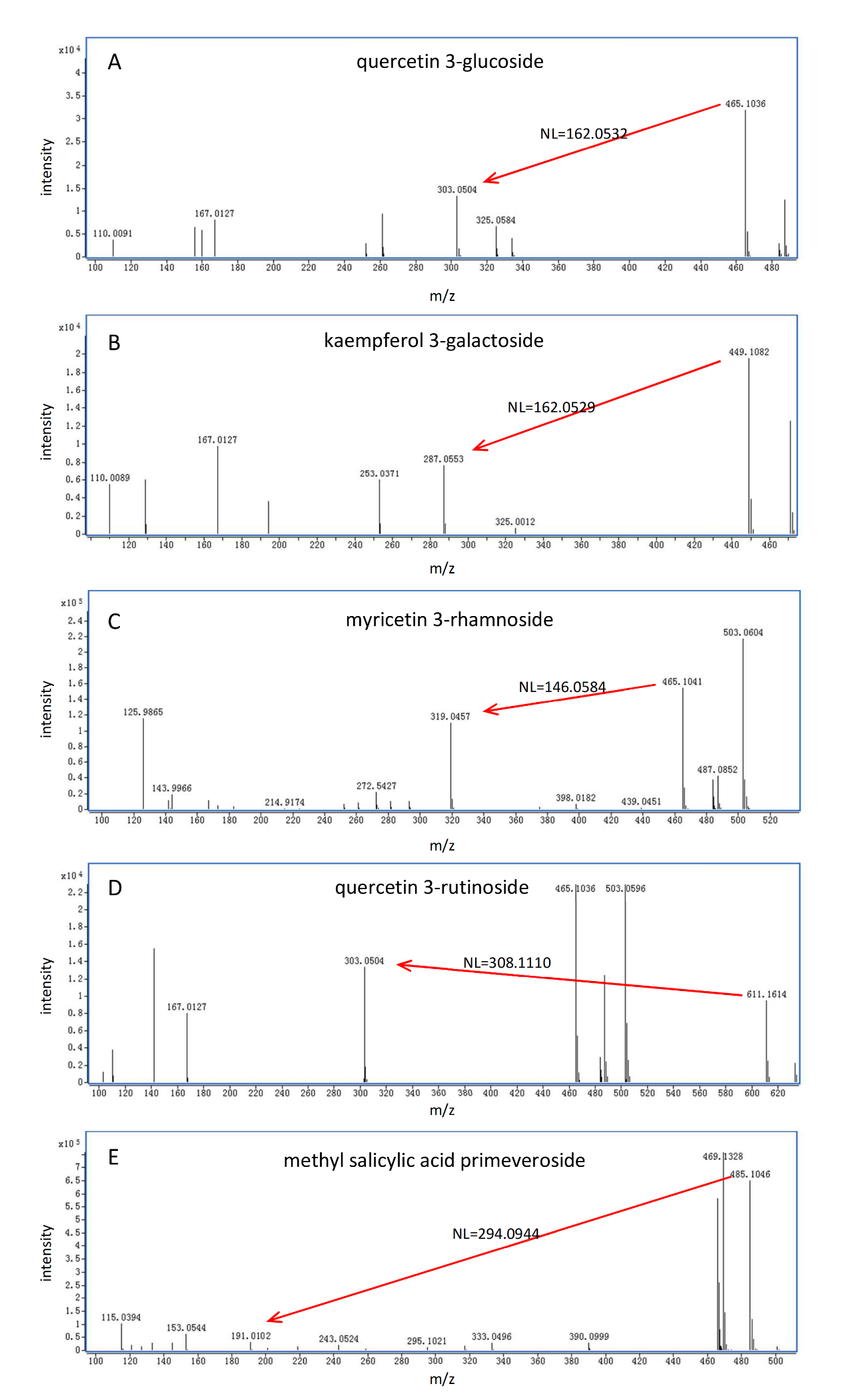
图3 糖基化代谢物的典型ISCID碎片模式
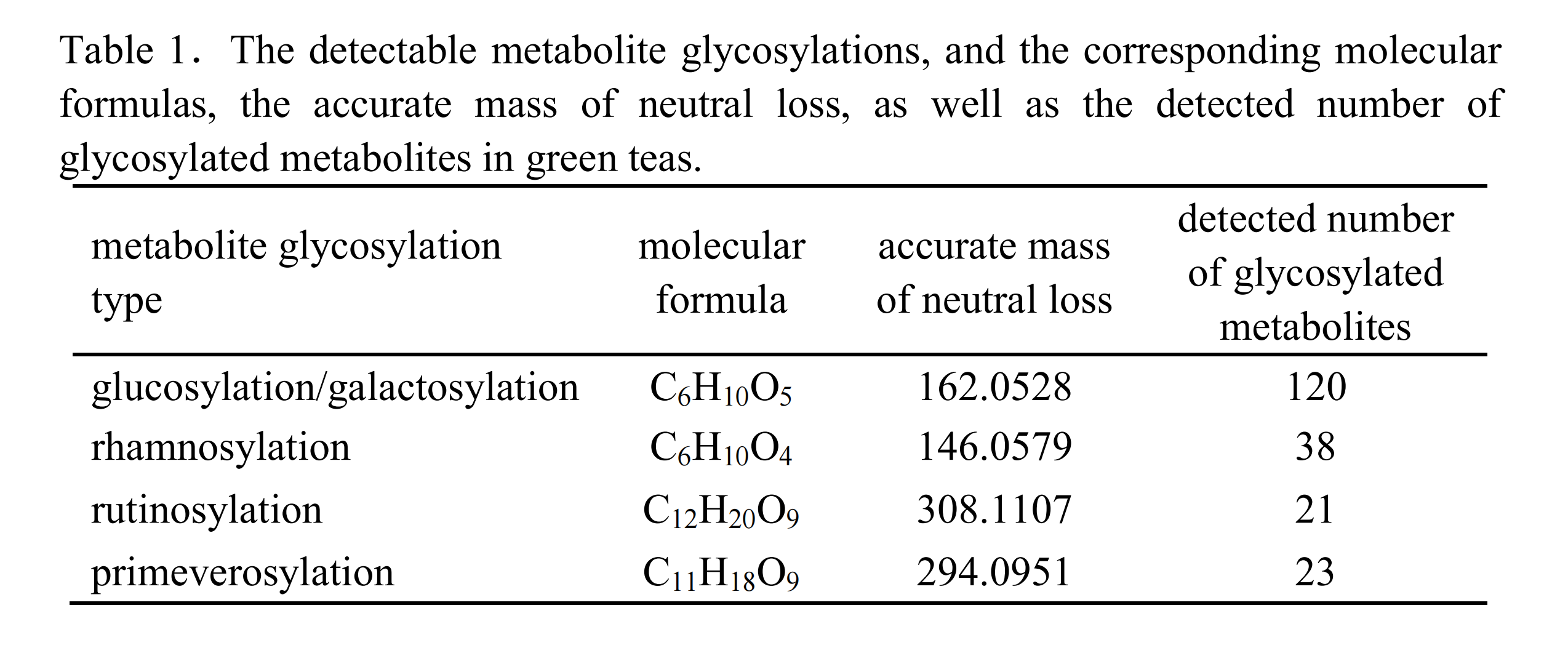
表1 可检测的代谢物糖基化和相应的分子式,中性损失的准确质量,以及检测到的绿茶中糖基化代谢物的数量
绿茶糖基化代谢物的分析
14种茶树品种混合的绿茶样本中,共鉴定出202种化合物,包括120种葡萄糖基化/半乳糖基化代谢物、38种鼠李糖基化代谢物、21种芸香糖基化代谢物和23种藤黄糖基化代谢物(表1)。随后,通过碰撞诱导解离(CID)模式下的串联质谱进一步验证代谢物的糖基化类型。其中144种化合物表现出源自特定糖基基团的中性丢失(表S1)。剩余的58种化合物因丰度较低,可能在MS²谱中未能检测到目标特征,因此未被进一步分析。上述144种化合物被选为后续结构鉴定的对象。
辅助糖基化代谢物的鉴定
得益于液相色谱-质谱联用技术(LC-MS)灵敏度和分辨率的快速提升,单个植物样本(如绿茶浸提物)中可同时获取数百甚至上千个离子特征信号。然而,仅极少数色谱和质谱信号能被结构解析,这一限制已成为植物代谢组学研究的瓶颈。
在本研究中,144种通过CID-MS²验证的糖基化化合物中,有61种可通过TMDB和HMDB数据库检索实现结构解析(表S1)。然而,糖基化代谢物的结构异构体和立体异构体无法仅通过串联质谱完全鉴定,且部分离子特征可能匹配多个糖基化代谢物候选物。因此,优先选择茶中已报道的候选物,并通过标准品验证(12种已通过标准品确认)进一步验证。这表明,非靶向特定修饰代谢组学方法可有效解析茶中的糖基化代谢物。
通过提前解析糖基部分,非靶向特定修饰代谢组学策略能克服代谢物鉴定的局限性,即大量糖基化代谢物尚未被发现或收录于数据库。该方法的策略如下(图4):
将推测糖基化代谢物列表中的离子特征导入代谢组学数据库进行结构鉴定;
若未匹配到候选物(0 hit),则将对应底物([M-sugar]+)作为替代目标进行数据库检索;
通过结合底物部分和糖基部分解析离子特征的结构。(注:此处的“底物”定义为优先选择茶中已报道的化合物作为参考)。
应用此策略,在绿茶浸提物中额外鉴定了40种新糖基化代谢物(表S1)。
以茶氨酸葡萄糖苷的鉴定为例:①一个离子特征(m/z=337.1599,保留时间2.26min)在非靶向特定修饰代谢组学分析中表现出NL=162.0524(对应葡萄糖基),因此被假设为糖基化代谢物;②该离子特征在TMDB和HMDB数据库中未匹配到候选物;③通过提前解析葡萄糖基,将其底物(m/z=175.1071,丢失一个葡萄糖)检索HMDB数据库,匹配到茶氨酸(茶中特有游离氨基酸,占干茶重量的1-2%)。因此,该离子特征被鉴定为茶氨酸葡萄糖苷(1-茶酰葡萄糖),并通过合成标准品进一步确认(图5)。由于该化合物此前未被报道,未来需开展大量工作以验证其他新糖基化代谢物。
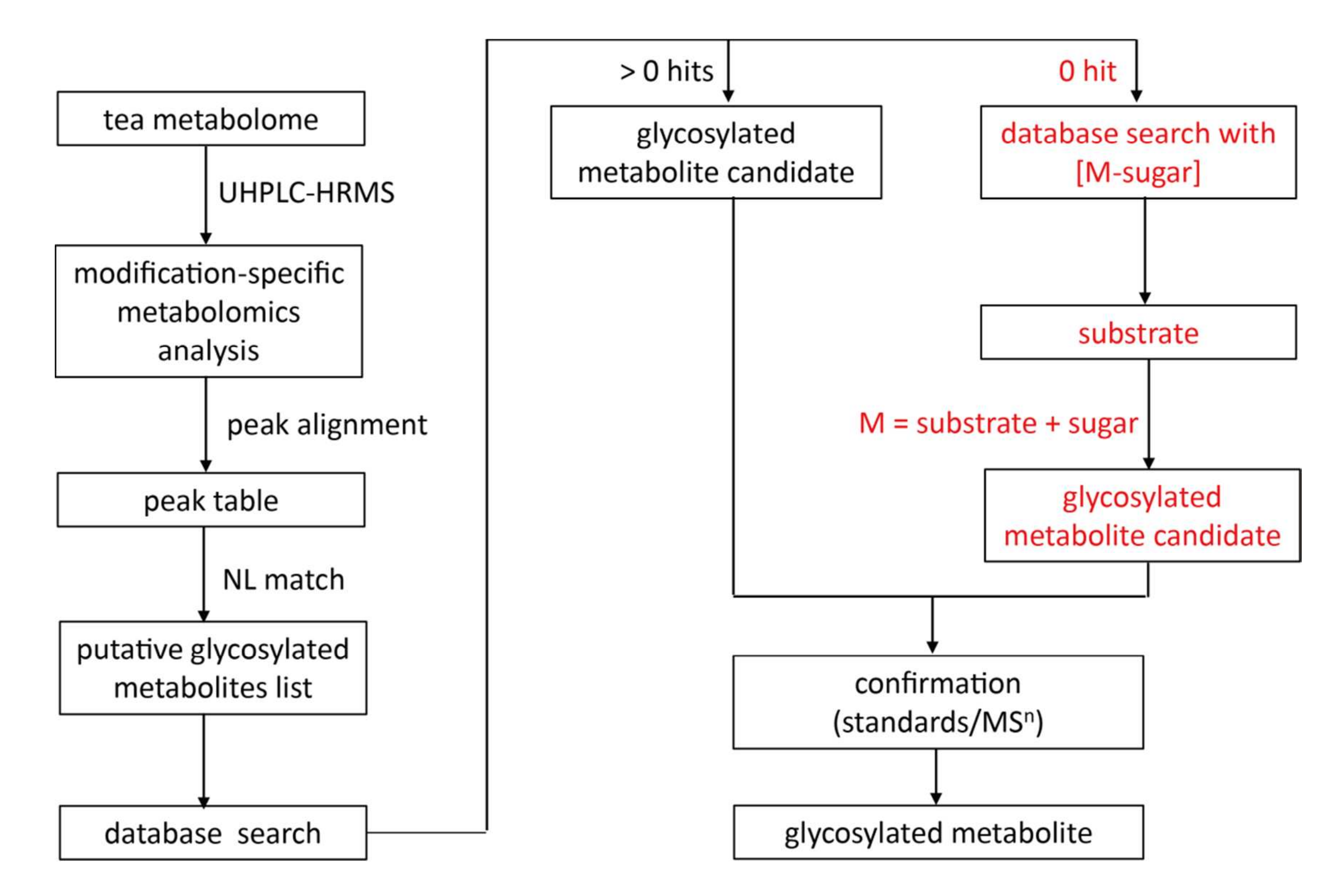
图4 茶树中糖基化代谢物发现与鉴定的特定修饰代谢组学流程
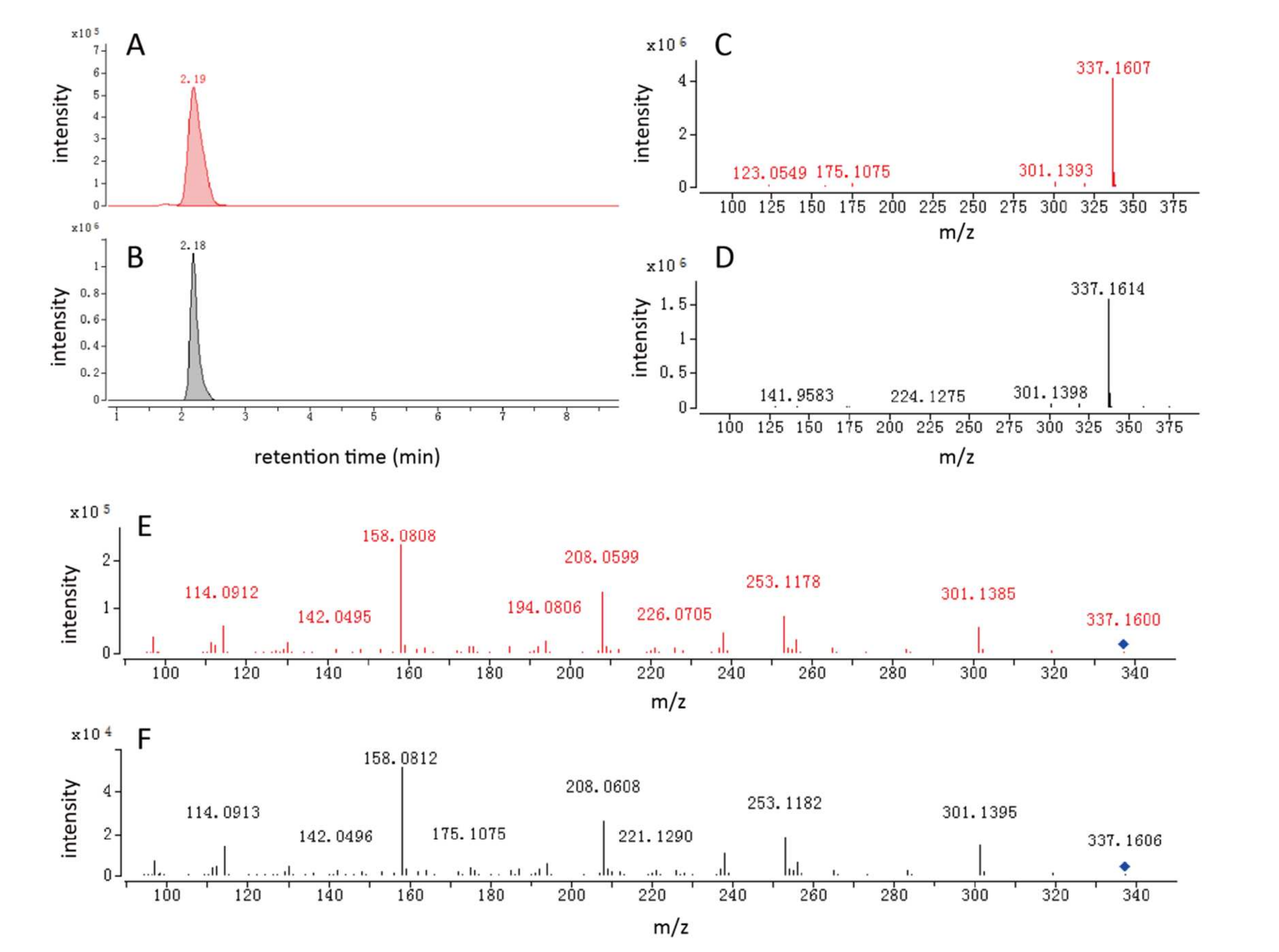
图5 茶氨酸葡萄糖苷的提取离子色谱图与质谱图
不同品种绿茶中糖基化代谢物的差异
作为概念验证,非靶向特定修饰代谢组学被应用于发现不同茶树品种间主要差异的糖基化代谢物;14个品种中糖基化代谢物的相对定量结果见表S2。如图6A所示,14种绿茶混合样本(QC样本)在主成分分析(PCA)得分图中心密集聚集,表明代谢组学分析具有良好的重复性。Zhenghedabai、Fuzao 2、Maoxie、Longjing 43、Yuemingxiang、Xicha 5和Echa 1的糖基化代谢物谱相似,这些品种通常用于制作非发酵茶(Fuzao 2、Longjing 43、Xicha 5、Echa 1)、轻发酵茶(Zhenghedabai)和半发酵茶(Maoxie、Yuemingxiang)。另一方面,Jianbohuang、Ningzhou 2、Gaoyaqi、Zhuyeqi、Wannong 95、Huang Guanyin和Fuyun 6的谱相似,这些品种通常用于制作发酵茶(Jianbohuang、Ningzhou 2、Gaoyaqi、Zhuyeqi、Wannong 95、Fuyun 6)和半发酵茶(Huang Guanyin)。
通过PCA载荷图(图6B)筛选出对茶品种差异起主要作用的糖基化代谢物。如图7所示,木犀草素-3-半乳糖苷、槲皮素-3-半乳糖苷、槲皮素-3-半乳糖基芸香糖苷、山柰酚-3-半乳糖苷和山柰酚-3,3’-二半乳糖苷在PCA得分图左侧区域(Zhenghedabai等品种)显著高于右侧区域(Jianbohuang等品种),而山柰酚-3-葡萄糖苷、山柰酚-3-芸香糖苷、山柰酚-3-葡萄糖基芸香糖苷、N’-甲酰犬尿氨酸二葡萄糖苷和麦拉三糖在左侧区域显著低于右侧区域。这表明,Zhenghedabai等品种的代谢物半乳糖基化活性更旺盛,而Jianbohuang等品种的葡萄糖基化活性较低。因此,推测糖基化/半乳糖基化比例可能与茶叶加工适配性相关:高半乳糖基化水平与非发酵茶加工适配性正相关,而高葡萄糖基化水平与发酵茶加工适配性正相关。
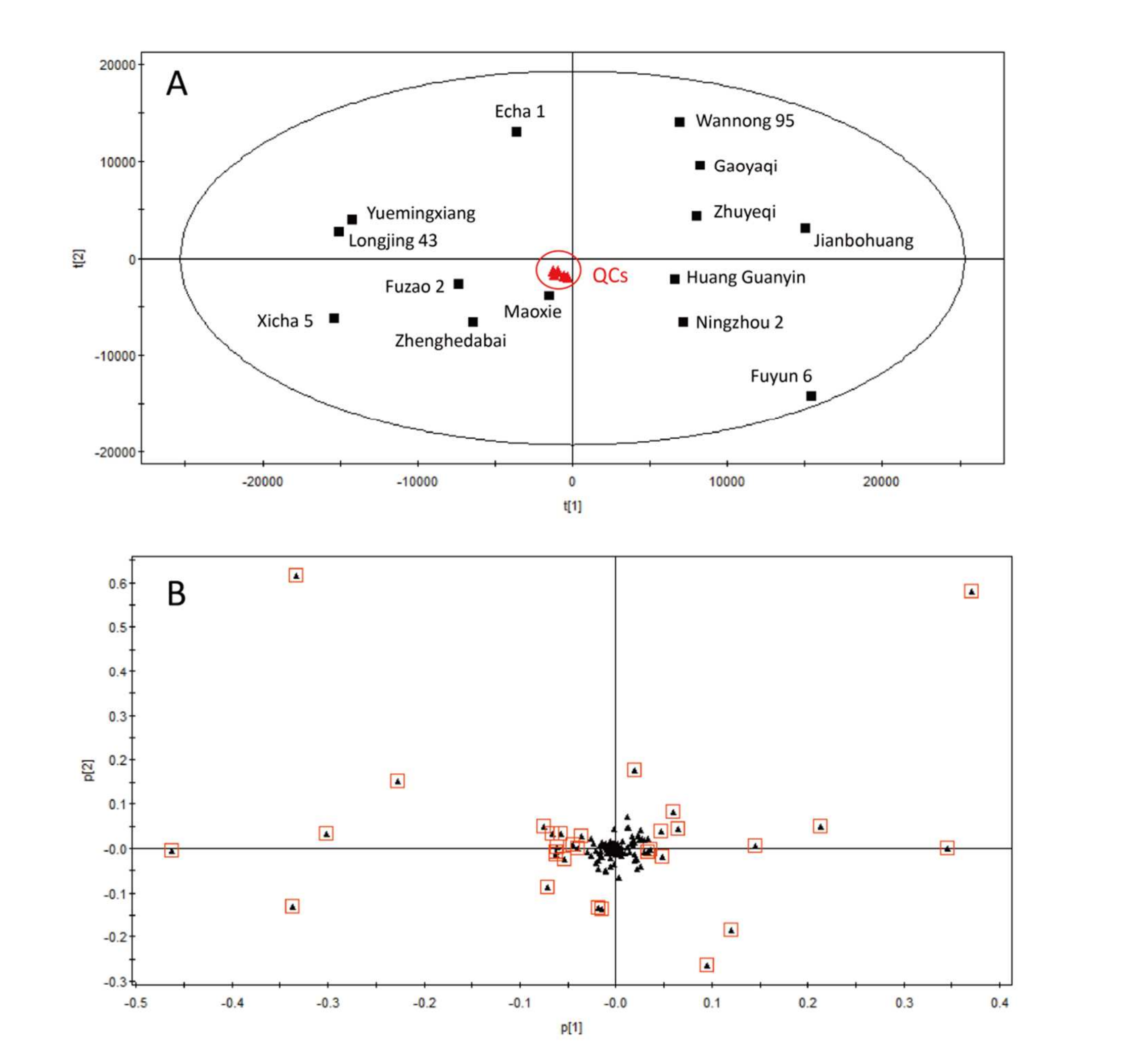
图6 十四种绿茶品种样本的主成分分析(PCA)
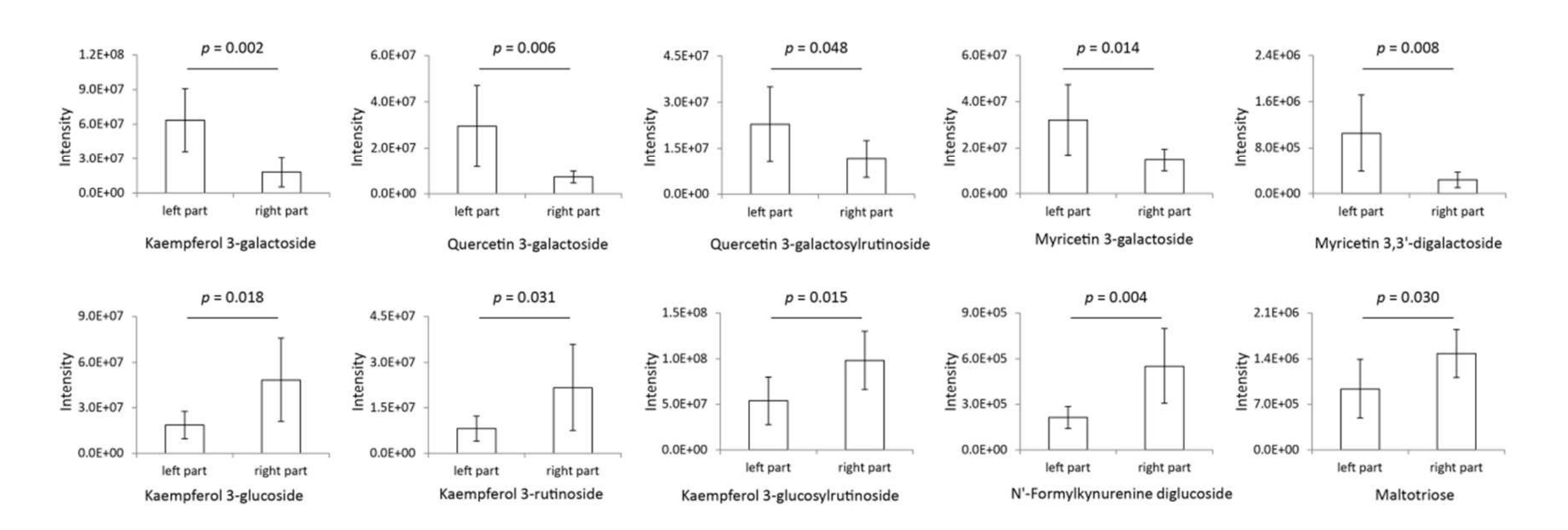
图7 PCA得分图左右区域品种间的主要显著糖基化代谢物差异
研究结论
本研究成功应用非靶向特定修饰代谢组学方法,系统解析了绿茶中葡萄糖基化、半乳糖基化、鼠李糖基化、芸香糖基化和素糖基化次级代谢物的特征。在绿茶中的应用中,总计检测到120种葡萄糖基化/半乳糖基化代谢物、38种鼠李糖基化代谢物、21种芸香糖基化代谢物和23种素糖基化代谢物。其中,61种糖基化代谢物可通过现有茶代谢物数据库初步鉴定。此外,得益于糖基部分的预先注释,该方法显著辅助了代谢物鉴定,额外发现了40种新型糖基化代谢物。总的来说,该方法显著扩大了糖基化代谢物的覆盖范围,并提升了未知代谢物的结构鉴定能力,为植物中新型糖基化代谢物的发现与鉴定提供了可行策略。未来可进一步扩展至其他重要修饰(如鞣酸化、肉桂酰化、香豆酰化和咖啡酰化)的植物代谢组研究。
